CIRISPR-Cas是细菌和古菌的免疫防御系统。2012年6月,Jennifer Doudna、Emmanuelle Charpentier 等人在 Science 期刊发表论文,揭示了CRISPR-Cas9的详细作用机制,并指出了其作为基因组编辑工具的潜力。此后,CRISPR基因编辑技术快速发展,成为最简单高效的基因编辑工具,并在基因功能研究、药物靶点筛选、遗传疾病治疗、癌症研究、作物育种等领域取得了突破性成就。她们二人也于2020年获得了诺贝尔化学奖。
基于基因编辑的基因疗法需要将基因编辑组分安全有效递送到目标细胞的细胞核中。病毒载体常用于基因递送,但其难以改变靶向细胞的类型,这限制了其在基因递送中的应用。非病毒载体被认为能够更安全、更灵活地用于基因编辑递送,但目前的非病毒递送仅限于体外细胞、局部给药或通过全身给药靶向肝脏。最近的一些研究例如SORT-LNP具有肝外靶向的潜力,但要想扩大体内基因编辑应用,还需要开发更多递送方式,在全身给药后靶向体内特定的器官、组织或细胞。
2024年1月11日,诺奖得主、加州大学伯克利分校 Jennifer Doudna 教授团队在 Nature Biotechnology 期刊发表了题为:In vivo human T cell engineering with enveloped delivery vehicles 的研究论文。

病毒或病毒载体的趋向性重靶向是一种已知的递送策略,将细胞选择性靶向分子与病毒糖蛋白一起在细胞表面展示,以在质膜或内体的低pH环境中通过融合进入细胞。最近有研究利用一种突变型水疱性口炎病毒糖蛋白(VSVG)——VSVGmut,它保持了内体融合活性,但缺乏天然的低密度脂蛋白受体结合亲和力。将VSVGmut与细胞特异性靶向分子配对可以重新定向慢病毒的转基因递送,并使T细胞和B细胞受体库的高通量筛选成为可能,以研究受体-抗原相互作用。
隐藏在细胞膜碎片中的颗粒——例如类病毒颗粒(VLP)、细胞外囊泡和仿生纳米颗粒,具有强大的递送潜力,受到越来越多的关注。对于这类包膜递送载体(Enveloped delivery vehicles,EDV),需要生物工程来实现对分子货物的包装和靶向及融合活性的控制。
在这项研究中,研究团队展示了通过将VSVGmut与抗体来源的单链可变片段(scFv)配对展示在包膜递送载体(EDV),用来包装Cas9核糖核蛋白复合物(Cas9 RNP),构建了Cas9-EDV,可以在体外和体内实现对人类细胞特异性的基因组编辑。该研究所述的包膜递送载体(EDV)利用逆转录病毒的类病毒颗粒(VLP)组装来实现对Cas9 RNP的瞬时递送。
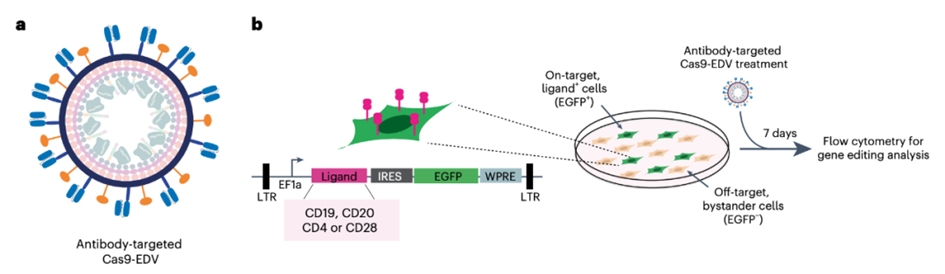
与依赖进化衣壳趋向性来递送的传统载体(例如AAV载体)相比,该研究开发的包膜递送载体(EDV)利用可预测的抗体-抗原相互作用,能够选择性地将基因组编辑组分(Cas9 RNP)瞬时递送至目标细胞。
在混合细胞群中,无论是体外还是体内,抗体靶向的Cas9-EDV优先在同源目标细胞中进行基因组编辑,而非旁观者细胞。通过使用多重靶向分子直接递送至人类T细胞,Cas9-EDV能够在人源化免疫系统的小鼠中产生基因组编辑的CAR-T细胞,而且没有向肝脏细胞脱靶递送。从而建立了一种可编程的递送策略,具有广泛的治疗应用潜力。
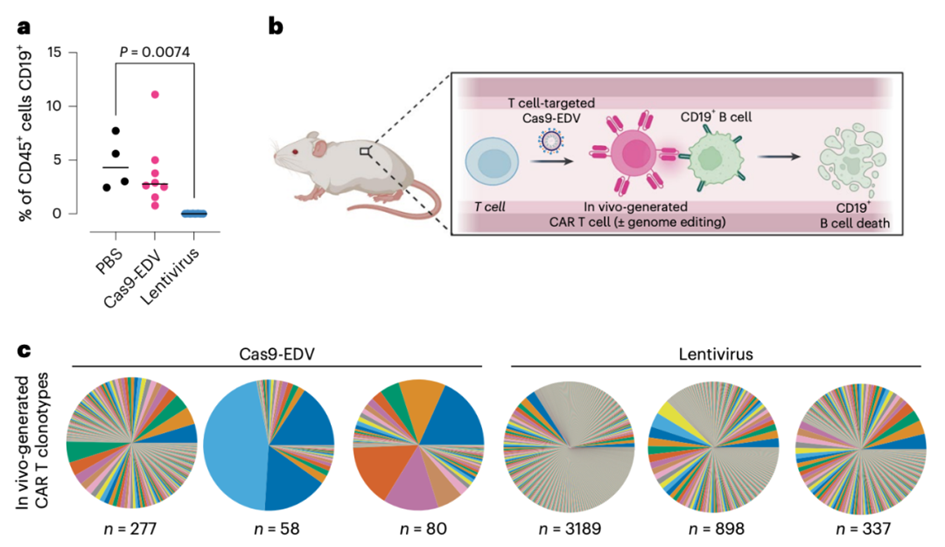
这些数据表明,包膜递送载体(EDV)是一个可编程递送平台,具有广泛的治疗应用潜力,能够将分子货物递送到特定的细胞类型,用于体内复杂的基因工程,包括基因递送和靶向基因破坏。
论文链接:
https://www.nature.com/articles/s41587-023-02085-z













